Sal
- ota: Para outros significados, veja Sal (desambiguação).
Em química, um sal é um composto iônico que em água se dissocia num cátion diferente de H+ e um ânion diferente de OH- [1]. Eles são tipicamente o produto de uma reação química entre:
- Uma base e um ácido: forma-se um sal e água. Por exemplo:
- Um metal e um ácido: forma-se um sal e hidrogênio. Por exemplo:
- Um óxido ácido e um óxido básico: forma-se um sal. Por exemplo:
Os íons que formam os sais podem ser monoatómicos (como o ânion fluoreto, F-, ou o cátion cálcio, Ca2+) ou poliatómicos (como o ânion sulfato, SO42-). Podem ainda ser inorgânicos (como o já referido sulfato) ou orgânicos (como o ânion acetato, CH3COO–).
Em geral, os sais formam cristais. São frequentemente solúveis em água, onde os dois íons se separam. Os sais em geral têm um alto ponto de fusão, reduzida ou elevada dureza e pouca compressibilidade. Se fundidos ou dissolvidos em água, conduzem electricidade, pois dissociam-se nos seus íons constituintes, passando estes a funcionar como electrólitos.
O sal mais popularmente conhecido é o cloreto de sódio, vulgarmente conhecido como "sal comum" ou "sal da cozinha", por ser largamente utilizado na alimentação humana [2].
Formulação
A fórmula empírica de um sal é determinada pelo número de ions, e sua cargas positivas e negativas. A fórmula empírica é uma expressão que representa a proporção mais simples na que estão presentes os átomos que formam um composto químico. Pode coincidir ou não com a fórmula molecular, que indica o número de átomos presentes na molécula.[3]
A fórmula química de um sal é sempre representada usando em primeiro lugar o cátion e depois o ânion. A fórmula química é uma representação de um composto químico.[4][3]
|
| |||||||||||||||||||||||||||||||||||||||
[editar]Nomenclatura
Um sal é designado juntando o nome do ânion e o nome do cátion que o constituem, por esta ordem. O ânion toma um nome de acordo com a terminação do nome do ácido que lhes dá origem. O nome de um sal normal deriva dos nomes do ácido e da base que lhes dão origem. Para um sal ser nomeado, é suficiente alterar a terminação do nome do ácido correspondente conforme tabela:[5]:
| Terminação do ácido | Terminação do ânion | Exemplo de ânion | Exemplo de sal |
|---|---|---|---|
| -ídrico | -eto | ácido clorídrico (HCl) → cloreto (Cl-) | cloreto de sódio (NaCl) |
| -ico | -ato | ácido fosfórico (H3PO4) → fosfato (PO43-) | fosfato de magnésio (Mg3(PO43-)2) |
| -oso | -ito | ácido sulfuroso (H2SO3) → sulfito (SO32-) | sulfito de potássio |
[editar]Usando a regra do número de oxidação
A terminação do nome do ânion depende do número de oxidação do seu átomo central:
| Nome do ácido | Número de oxidação | Ânion (átomo central) |
|---|---|---|
| hipo...oso | +1,+2 | hipo...ito |
| ...oso | +3, +4 | ...ito |
| ...ico | +5, +6 | ...ato |
| per...ico | +7 | per...ato |
[editar]Tipos de Sais
A neutralização dos ácidos pelas bases pode ser total ou parcial, dando origem a sais ácidos, básicos, neutros, mistos ou hidratados [6].
Sal ácido (hidrogeno-sal) é formado por dois cátions e somente um ânion; o básico (hidróxi-sal) apresenta dois ânions e um cátion; o sal neutro é caracterizado pela neutralização total de um ácido ou de uma base, ou seja estão isentos de íons H+ e OH-, com consequente ausência na fórmula dos íons H+ e OH-; o sal misto é composto por dois cátions ou dois ânions diferentes; o sal hidratado é aquele que na sua composição é encontrado água. As moléculas de água ficam localizadas no retículo cristalino da estrutura salina.
[editar]Propriedades dos sais
Muitos sais são sólidos à temperatura ambiente apresentando elevado ponto de fusão. Alguns sais são bastante duros e todos são quebradiços, pois são sólidos cristalinos.
Muitos sais são solúveis em água e insolúvel em solventes orgânicos.
Os chamados sais neutros não alteram o pH de uma solução, o cloreto de sódio é o melhor exemplo deste tipo de sal. Outros sais podem levantar ou baixar o pH de uma solução, dependendo da de sua acidez ou alcalinidade.
Cristais de sal secos são isolantes elétricos. Sais em soluções aquosas ou fundidos são condutores de corrente elétrica.
[editar]Reações de sais inorgânicos
[editar]Reação de ácidos e bases
São os sais formados na reação entre ácidos e bases. Alguns sais provenientes deste processo são pouco solúveis em água, mantendo-se como sólidos. Também no processo deevaporação da água, o sal obtido também é um sólido. Exemplos de reações:
| ácido + base → sal + água |
|---|
 ácido clorídrico + hidróxido de sódio → cloreto de sódio + água |
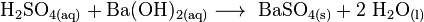 ácido sulfúrico + hidróxido de bário → sulfato de bário + água |
[editar]Reações de sais com outros sais
Alguns sais podem ser obtidos a partir de dois outros sais. Por mistura de soluções aquosas de dois sais, pode ser formado um terceiro sal na forma de um sólido. Isto só é possível se o novo sal é menos solúvel, que os dois sais que participaram da reação química. Exemplos de reações:
| solução salina A + solução salina B → sal C + solução salina D |
|---|
 cloreto de sódio + nitrato de prata → cloreto de prata + nitrato de sódio |
 cloreto de cálcio + carbonato de sódio → carbonato de cálcio + cloreto de sódio |
[editar]Reação com óxidos
Óxidos de metais tendem a formar hidróxidos com água. Sob condições ácidas, eles reagem como óxidos de metal, e são insolúveis em água pura. Exemplos de reações:
| óxido + ácido → sal + água |
|---|
 óxido de cobre (II) + ácido sulfúrico → sulfato de cobre + água |
[editar]Lista de sais
- acetatos são os sais do ácido acético [7]
- carbonatos são os sais do ácido carbônico [8]
- cloretos são os sais do ácido clorídrico [9]
- cianetos são os sais do ácido prússico, mais conhecido por ácido cianídrico [10]
- sulfetos são os sais do ácido sulfídrico
- nitratos são os sais do ácido nítrico [8]
- nitritos são os sais do ácido nitroso
- fosfatos são os sais do ácido fosfórico [8]
- sulfatos são os sais do ácido sulfúrico [11]
1,96 [11] - citratos são os sais do ácido cítrico [12]




Nenhum comentário:
Postar um comentário